浅谈CRISPR/Cas9基因编辑技术
基于系统发育、基因组和结构分析的证据,现有的规律间隔成簇短回文重复序列(CRISPR/Cas)系统可以分为Ⅰ型、Ⅱ型、Ⅲ型,其中Ⅱ型系统是最常用的基因编辑工具,CRISPR/Cas9系统属于其中之一。2020年诺贝尔化学奖授予法国科学家艾曼纽尔·卡彭蒂耶(Emmanuelle Charpentier)和美国科学家詹妮弗·杜德纳(Jennifer A.Doudna),以表彰她们发现基因编辑技术中最大的利器之一——CRISPR/Cas9。
CRISPR/Cas9系统
CRISPR/Cas9系统由Cas9蛋白和gRNA共同构成,Cas9蛋白包含两个主要的核酸酶结构域——RuvC结构域和HNH结构域,前者切割非互补DNA链,后者切割互补DNA链;gRNA是起支架功能的反式激活的crispr RNA(tracrRNA)与特异性的crispr核糖核酸(crRNA)结合形成的嵌合RNA,用于将Cas9导向其靶标。为了方便实验设计以及提高gRNA的稳定性,艾曼纽尔·卡彭蒂耶和詹妮弗·杜德纳将crRNA和tracrRNA融合成一条RNA,并把其称为sgRNA (single-guide RNA),改造后的CRISPR/Cas9系统成为研究者做基因编辑的首选工具[1,2]。
◆CRISPR/Cas9基因编辑技术的核心
●Cas9蛋白
核酸内切酶,定点切割特定核苷酸位点。
●gRNA引导序列
可理解为该技术的GPS导航系统,引导Cas9靶向修饰。
●修饰后基因序列
该基因序列可以是正常基因,含理想突变,插入或敲除某段基因的核苷酸序列。
◆CRISPR/Cas9基因编辑原理
●第一阶段:CRISPR的高度可变间隔区的获得(俘获外源DNA,登记“黑名单”)
CRISPR的高度可变间隔区的获得是指外来入侵的噬菌体或是质粒DNA的一小段DNA序列被整合到宿主菌的基因组,整合的位置位于CRISPR5'端的两个重复序列之间,该阶段可以分为3步[3]:
第1步:Cas1和Cas2编码的蛋白扫描入侵的DNA,并识别出原间隔序列邻近基序(PAM),然后将临近PAM的DNA序列作为候选的原间隔序列。其中PAM通常由NGG(N为任意碱基)3个碱基组成。
第2步:Cas1/2蛋白复合物将原间隔序列从外源DNA中剪切下来,并将原间隔序列插入临近CRISPR序列前导区(位于CRISPR基因上游,是富含AT且长度为300-500bp的区域)的下游。
第3步:DNA通过非同源末端连接(NHEJ)或同源定向修复(HDR)途径进行修复,将打开的双链缺口闭合。这样一来,一段新的间隔序列就被添加到了基因组的CRISPR序列之中。
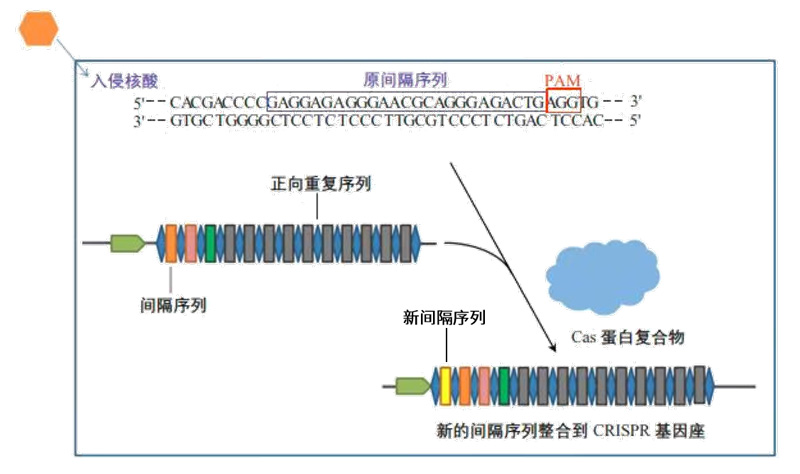
CRISPR获得新间隔序列[3]
●第二阶段:CRISPR基因座的表达(包括转录和转录后的成熟加工)
CRISPR序列在前导区的调控下转录产生pre-crRNA和与pre-crRNA序列互补的tracrRNA。pre-crRNA通过碱基互补配对与tracrRNA形成sgRNA并与Cas9蛋白形成复合体。它根据入侵者的类型,选取对应的间隔序列RNA,并在RNaseⅢ的协助下对PAM进行剪切,最终形成一段短小的crRNA(包含单一种类的间隔序列RNA以及部分重复序列区)。crRNA、tracrRNA以及Cas9组成最终的复合物,为下一步剪切做好准备。现在使用CRISPR/Cas系统进行基因编辑大多使用人工合成的sgRNA[4]。
●第三阶段:CRISPR/Cas9系统活性的发挥(靶向干扰)
crRNA、tracrRNA以及Cas9组成的最终复合物将扫描整个外源DNA序列,并识别出与crRNA互补的原间隔序列。这时,复合物将定位到PAM/原间隔序列的区域,DNA双链将被解开,形成R-Loop。crRNA将与互补链杂交,而另一条链则保持游离状态。随后,Cas9蛋白精确地切割PAM的5’端方向的第三个碱基,形成平末端产物,Cas9蛋白的HNH结构域负责切割与crRNA互补配对的DNA链,而RuvC结构域负责切割另外一条非互补DNA链。最终在Cas9的作用下DNA双链断裂(DSB),外源DNA的表达被沉默[4]。
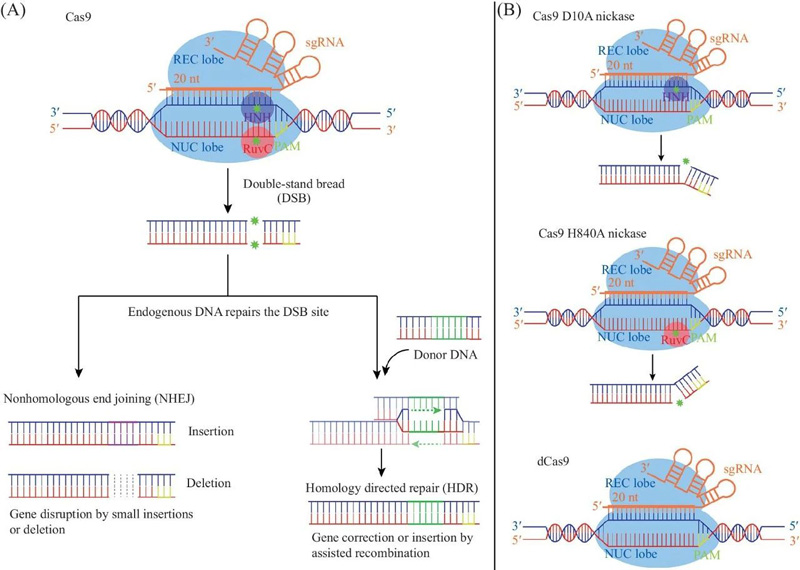
基于CRISPR/Cas9的基因编辑原理[4]
◆CRISPR/Cas9介导基因敲除
在基因的上下游各设计一条sgRNA,将其与含有Cas9蛋白编码基因的质粒一同转入细胞中,sgRNA通过碱基互补配对可以靶向PAM附近的目标序列,Cas9蛋白会使该基因上下游的DNA双链断裂。生物体通过NHEJ或HDR途径将断裂上下游两端的序列连接起来,从而实现了细胞中目标基因的敲除。
◆CRISPR/Cas9介导基因替换/突变
基因替换或者突变:在上下游DNA双链断裂基础上,引入一个修复的模板质粒(供体DNA分子),细胞按照提供的模板在修复过程中引入片段插入或定点突变。
◆CRISPR/Cas9技术优势
●操作简单,靶向精确性高;
●可实现对靶基因单个位点或多个位点同时敲除,也可同时对多个靶基因进行敲除;
●应用范围广,可用于大多数物种的基因编辑;
●CRISPR/Cas9系统是由RNA调控的对DNA的修饰,对基因修饰可遗传。
CRISPR/Cas9基因编辑技术在医学领域的应用
CRISPR/Cas9在构建动物疾病模型,寻找疾病治疗的有效靶点,治疗感染性疾病、肿瘤疾病以及遗传性疾病中发挥重要作用。除此之外,CRISPR/Cas9基因编辑技术与PCR和DNA测序等技术的结合,使人们能快速识别新发传染病病原体,有助于疾病的及时治疗。
◆在感染性疾病中的应用
CRISPR/Cas9基因编辑系统成功应用于人类免疫缺陷病毒(HIV)基因组的定向编辑,以抑制HIV感染、清除病毒,甚至诱导潜伏病毒转录激活而予以消除,具有治疗HIV感染的潜力。除此之外,Kennedy EM等首先尝试了将CRISPR/Cas9系统应用于乙型肝炎病毒(HBV)感染的研究,采用CRISPR/Cas9系统在HBV感染的细胞核中对病毒共价闭合环状DNA进行特异性切割,并取得了较好的疗效[5,6]。近年来,CRISPR/Cas9系统还成功应用于其他一些DNA病毒的基因编辑,如高危人乳头瘤病毒(HPV)、疱疹病毒、牛痘病毒、JC多瘤病毒、禽腺病毒4型以及非洲猪病毒等[5,6]。
◆在肿瘤疾病中的应用
CRISPR/Cas9系统是促进肿瘤基因水平治疗的突破性发展,如构建肿瘤模型、靶向敲除癌基因致病位点、恢复抑癌基因活性、减少肿瘤细胞耐药性、进行肿瘤免疫治疗等。研究发现利用CRISPR技术敲除肺癌患者程序性死亡受体-1(PD-1)可促进细胞启动免疫反应,Kim等使用CRISPR技术编辑的CD33基因敲除的造血干细胞和原代细胞可以产生功能性造血,但对抗原靶向治疗有抵抗力,不受CD33靶向嵌合抗原受体T(CAR-T)细胞的影响,使CAR-T细胞免疫治疗急性髓系白血病成为可能[7]。Wang等发现在癌细胞中删除E3泛素连接酶Cop1会减少巨细胞相关趋化因子的分泌,减少肿瘤巨噬细胞浸润,增强抗肿瘤免疫力。CRISPR/Cas9技术介导实现基因敲除肽基脯氨酰异构酶A(PPIA),有效提高了多发性骨髓瘤细胞对蛋白酶体抑制剂的敏感程度[7]。
◆在遗传性疾病中的应用
纠正遗传性疾病相关的点突变同时保留遗传功能的策略是治疗遗传性疾病的理想方法之一。CRISPR/Cas9技术可以通过Cas9在突变位点处或附近引入DNA DSB,然后通过NHRJ或HDR途径诱导不同类型的插入,导致基因突变、敲入、删除、反转等,有机会纠正基因组中相应缺陷,从而达到治疗遗传疾病的效果[8]。
2014年,Yin等报道了一项在成年小鼠体内进行的CRISPR/Cas9介导的HDR纠正Fah基因点突变的研究,证明了利用CRISPR/Cas9介导的基因编辑纠正基因突变在成年动物中是可行的,并且具有纠正人类遗传疾病基因突变的潜力。这种策略也被应用于其他类似遗传疾病的研究,如Yang等利用同样的技术成功校正了小鼠Otc基因外显子的G→A点突变,证实了该疗法对新生小鼠高氨血症的治疗效果[8]。此外,HDR介导的点突变校正也已应用于包括β-地中海贫血、慢性肉芽肿病、Duchenne肌肉萎缩症、镰状细胞病和严重联合免疫缺陷,除此之外,CRISPR/Cas9技术已应用于大鼠、小鼠、猪、猴等各类动物模型,表明CRISPR/Cas9技术在治疗遗传性疾病方面具有巨大潜力[8]。
◆在分子诊断方面的应用
把Cas9和聚合酶链式反应(PCR)结合起来可用于辅助的特异性诊断[9]。目前,基于CRISPR的核酸检测从原理上分为2种:(1) 利用 Cas9等Cas蛋白高特异性识别并结合双链DNA(dsDNA)的特性;(2)利用Cas13、Cas12等Cas蛋白特异性识别核酸后,旁路切割活性激活,非特异性切割单链DNA(ssDNA)或单链RNA(ssRNA)的特性[10]。
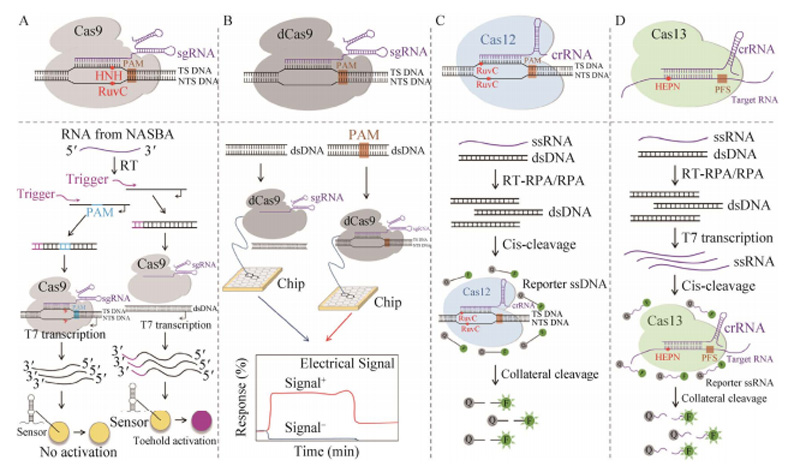
基于CRISPR的核酸检测技术[10]
2016年,Collins首次将CRISPR/Cas9系统引入核酸分子诊断,开发了一种鉴别寨卡病毒谱系的新技术[9]。除此之外,Zhou等创新性地提出利用CRISPR系统效应蛋白Cas9在与靶核酸分子结合过程中的构象变化,作为链取代等温扩增反应的开关,高效启动针对靶核酸分子的指数倍扩增,简称为CRISDA技术[11]。相比于传统PCR和其他等温扩增技术,CRISDA技术灵敏度更高、特异性和普适性更强,但需要复杂的反应试剂,包括spyCas9-sgRNA、nickking核酸内切酶、单链DNA结合蛋白(SSB)、Klenow片段、引物对、肽核酸(PNA)探针、链霉亲和素标记的磁珠等[12]。
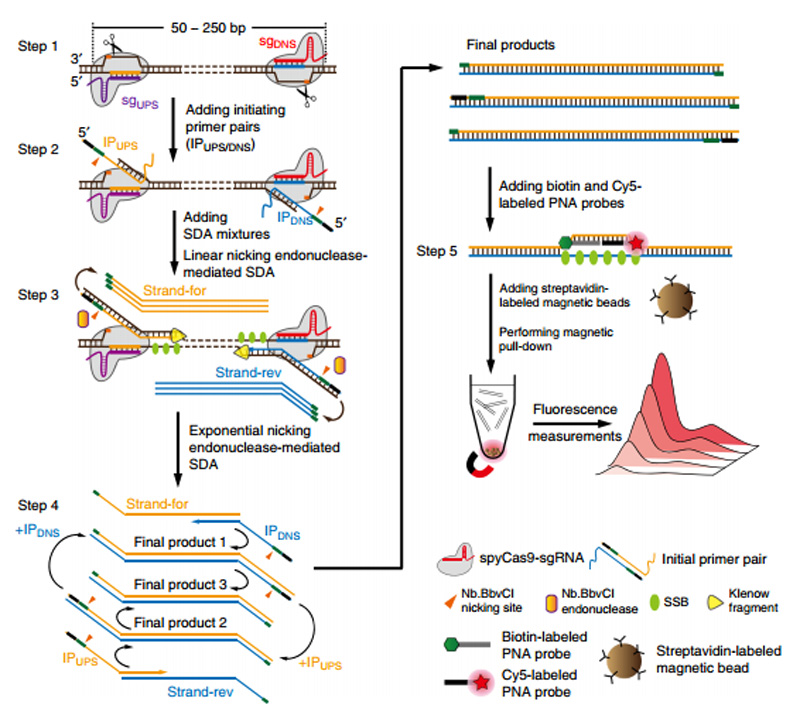
CRISDA的反应机制[11]
另外,Wan等还开发了另一种称为基于Cas9n的扩增反应(Cas9n AR),该方法可以在37℃的恒定温度下从基因组DNA中扩增靶片段[12]。
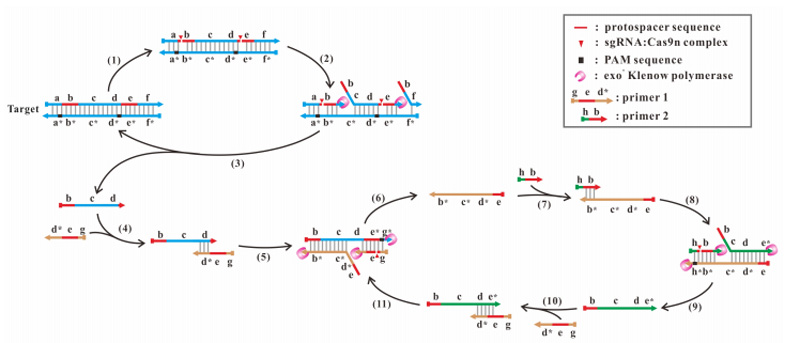
基于Cas9n的扩增反应[12]
除PCR外,2019年,一种名为FLASH技术被用于富集低丰度的病原体抗菌素耐药性序列。FLASH技术使用一组Cas9的sgRNA,并设计用于将感兴趣的序列切割成适合测序的大小片段,输入基因组DNA或DNA首先被磷酸酶处理阻断,然后用于这组sgRNA混合的Cas9酶切消化,因此所得的切割产物能够连接通用测序衔接子[9]。
参考文献:
[1] 王瑞,周欣洁,杜熙钦等.新一代基因编辑工具研究进展[J].中国药科大学学报,2022,53(06):633-642.
[2] Janik E, Niemcewicz M, Ceremuga M, et al. Various Aspects of a Gene Editing System-CRISPR-Cas9. Int J Mol Sci. 2020 Dec 16;21(24):9604.
[3] 方锐, 畅飞, 孙照霖, 等. CRISPR/Cas9 介导的基因组定点编辑技术[J]. 生物化学与生物物理进展, 2013, 40(8): 691-702
[4] 林锦莹,赵兰,欧阳松应.CRISPR/Cas9:基因编辑的新时代[J].中国细胞生物学学报,2021,43(03):647-654
[5] 薛珊, 王淑雅, 刘丽等. 基于CRISPR/Cas9的精准基因编辑技术研究进展[J]. 生物工程学报, 2023, 39(7): 2566-2578.
[6] 滕蔓,刘金玲,郑鹿平等.CRISPR/Cas9基因编辑技术在病毒学研究中的应用及进展[J].病毒学报,2020,36(05):946-954.
[7] 于宗菲,翁丽涵,孙诚诚等.CRISPR/Cas9系统技术难关:脱靶效应及其优化方法[J].山东第一医科大学(山东省医学科学院)学报,2023,44(01):74-80.
[8] 朱佩琪,蒋伟东,周诺.CRISPR/Cas9基因编辑系统的发展及其在医学研究领域的应用[J].中国比较医学杂志,2019,29(02):116-123.
[9] 刘晓静,原志伟,刘振波.基于CRISPR/Cas系统的分子诊断技术原理及应用研究进展[J].质量安全与检验检测,2021,31(03):57-60+96.
[10] 孙雯君,黄行许,王鑫杰.基于CRISPR的快速灵敏便捷分子检测[J].生物工程学报,2023,39(01):60-73.
[11] Zhou W, Hu L, Ying L, et al. A CRISPR-Cas9-triggered strand displacement amplification method for ultrasensitive DNA detection. Nat Commun. 2018 Nov 27;9(1):5012.
[12] Wang T, Liu Y, Sun HH, et al. An RNA-Guided Cas9 Nickase-Based Method for Universal Isothermal DNA Amplification. Angew Chem Int Ed Engl. 2019 Apr 8;58(16):5382-5386.








