CRISPR/Cas基因编辑技术的回首与展望
前言
对基因进行自由编辑一直是生物学家的梦想,随着CRISPR/Cas系统这一强大基因编辑工具的发现及应用,这一梦想终于成真。起初,科学家发现CRISPR/Cas9、CRISPR/Cas12等多种CRISPR/Cas系统可用于真核细胞DNA的编辑,随后又陆续发现CRISPR/Cas13a、CRISPR/Cas13b等靶向RNA分子。不仅如此,通过各种各样的改造,科学家还开发一系列新型CRISPR/Cas系统,这些人工改造的基因编辑系统比天然的CRISPR系统具有更高的DNA切割活性、更强的特异性以及更小的体积,它们形成了一个强大的工具集,可用于基因序列的敲除、替换、表观遗传编辑甚至基因表达的激活和抑制。此外,CRISPR/Cas基因编辑技术联合不断提升的计算机和成像水平,能够精确诊断疾病并基于个体基因组预测疾病易感性,甚至能够改造遗传信息,该技术同样能够鉴定和快速改造植物性状的基因,加快农业研究和植物育种的速度[1,2]。CRISPR/Cas系统自发现以来持续推动着生命科学领域的进步,然而这一切仅仅是初露锋芒。
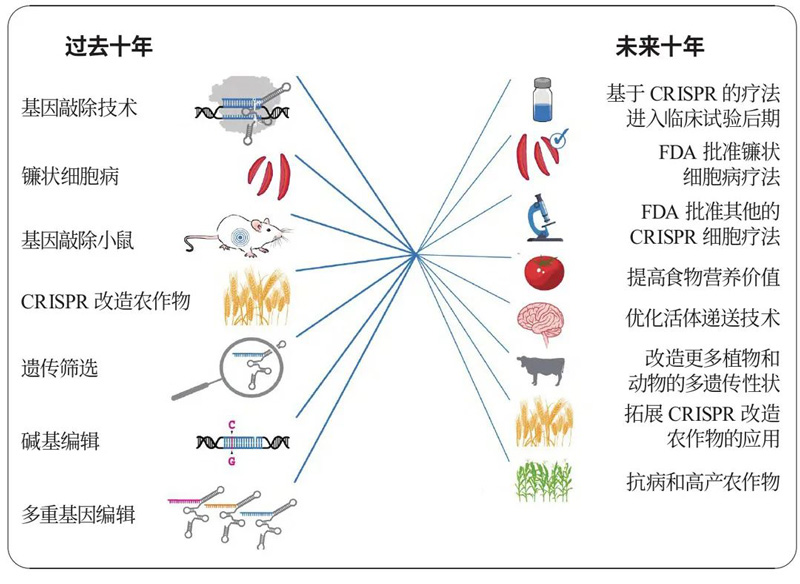
CRISPR/Cas基因编辑技术过去和未来十年[1]
CRISPR/Cas基因编辑技术过去
◆CRISPR/Cas基因编辑技术的发展
1987年,CRISPR序列首次被报道;2002年被Jansen等正式命名,由这些序列和基因组成的系统我们称之为CRISPR/Cas系统;2005年,研究者发现CRISPR中的居间序列并非细菌自身染色体所有,而是与病毒的部分基因组序列高度一致,因此推测细菌可通过特定方式获取病毒DNA片段并整合到自身CRISPR序列中,当再次遇到相同的入侵者时,细菌可利用这些序列信息进行识别并将其破坏;2012年,Jennifer Doudna和Emmanuelle Charpentier等人证明CRISPR/Cas9系统可在体外切割双链DNA。2013年,Jennifer Doudna、George Church和张锋分别带领3个研究团队相继证明了CRISPR序列与Cas9蛋白结合后,可在人类细胞中高效地定位、剪切和修改基因组。此后,CRISPR技术迅速发展,多个具有特定功能的Cas9变异体被鉴定出来。自2016年以来,基于CRISPR的基因编辑技术陆续应用于临床并取得了巨大成功[3,4]。
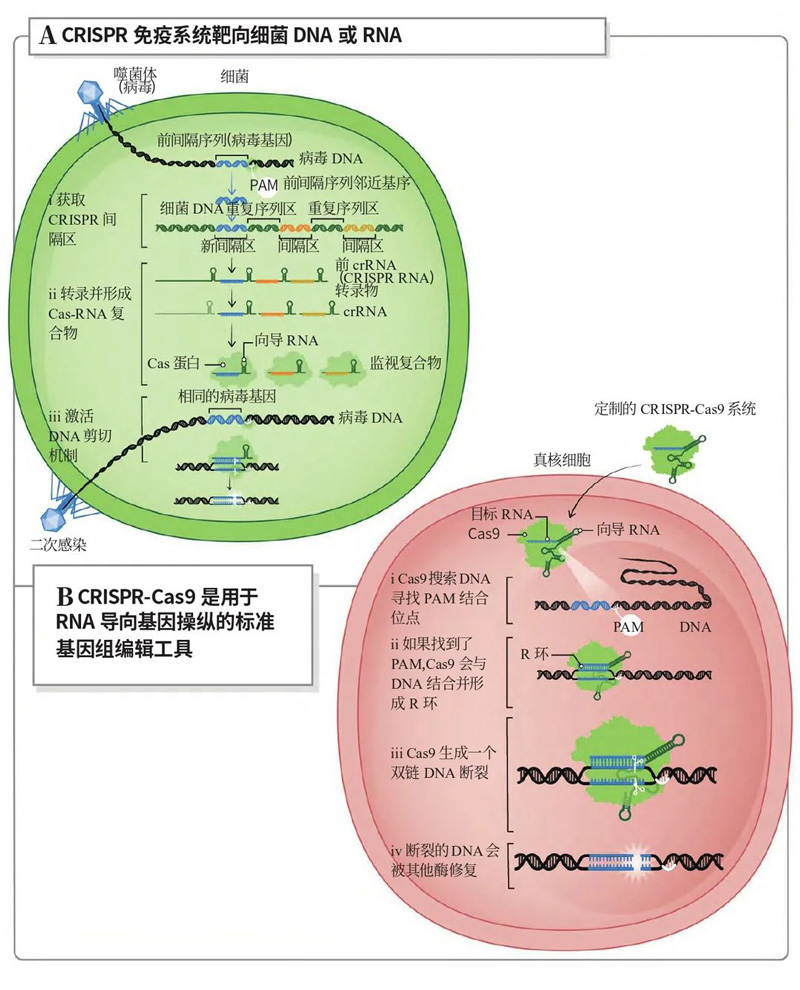
基于CRISPR的获得性免疫提供可编程的基因编辑工具[1]
◆CRISPR/Cas基因编辑技术的应用
●基因编辑方面
CRISPR/Cas系统作为基因组编辑工具的强大功能表现在以下5点:①切割DNA的位点的机制由RNA序列的识别所决定的;②相同的蛋白质(如Cas9)可以通过简单地交换向导RNA(gRNA)来靶向范围广泛的DNA序列;③在真核细胞中,DNA断裂得到有效修复,可以随意对DNA序列进行靶向更改;④工程化CRISPR/Cas可以转录抑制或激活以沉默或上调特定基因;⑤其他形式的工程化Cas9与酶融合,可实现单个核酸碱基编辑、染色质修饰或序列插入[1,2]。
过去十年,CRISPR/Cas系统作为基因组编辑工具,应用集中在以下五个方面[1,2]:
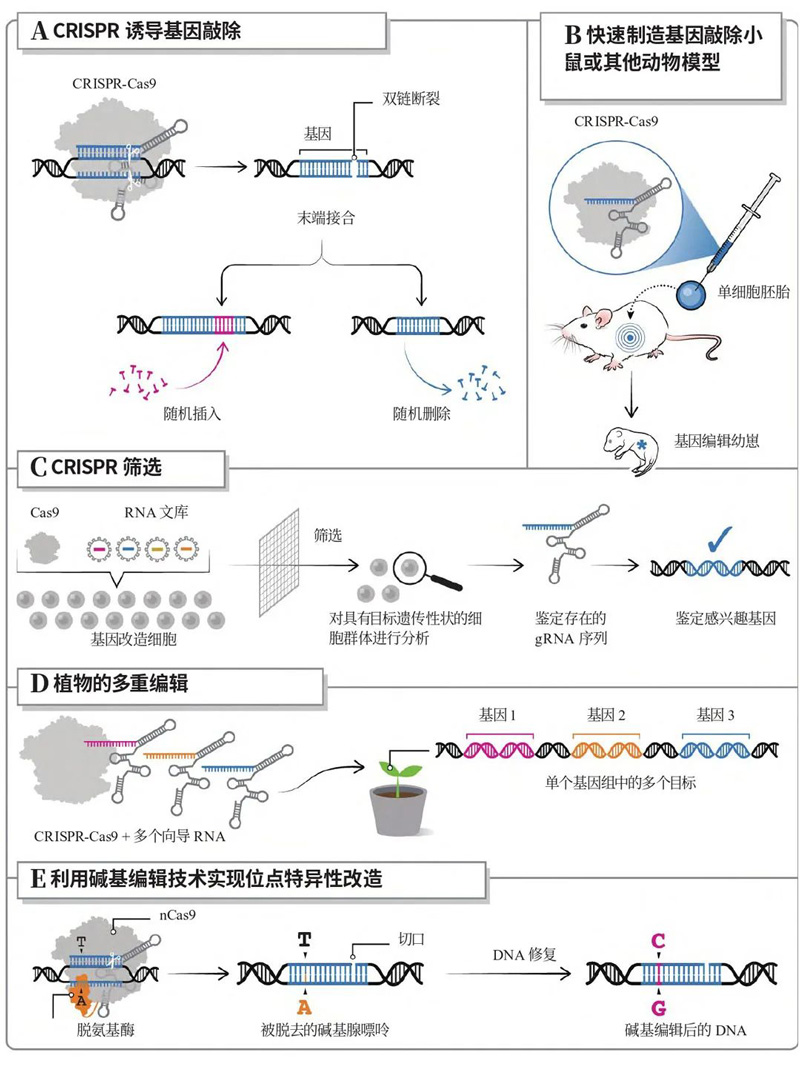
CRISPR/Cas基因编辑技术的应用[1]
A.诱导基因敲除:由于CRISPR/Cas9的高靶向特异性和功效,此类基因敲除在研究应用中已成为常规,为功能研究提供了破坏基因的简化过程。
B.动物模型:基因敲除小鼠等动物模型的制作速度大大提高,可以编辑单细胞胚胎,生成基因修饰小鼠。
C.基因筛选:CRISPR/Cas9编辑将遗传扰动引入模型,该模型进行选择分析,然后读出以评估扰动的影响。
D.多重编辑:多个gRNA可与Cas9一起使用,以同时编辑基因组中的多个目标。
E.碱基编辑:CRISPR碱基编辑器通常由与脱氨酶融合的nCas9(一种突变型Cas9,其突变使其在特定的靶位点具有较低的结合亲和力)或dCas9(一种失活的Cas9变体,即在其核酸酶活性中心的两个关键氨基酸发生突变,使其失去了切割DNA的能力)组成,无需DNA双链断裂即可实现位点特异性修饰。
●临床应用
在过去十年,研究者根据大量生物化学和结构解析的研究结果,基于CRISPR/Cas系统开发出众多成像技术和诊断方法。并开展了一系列临床试验,用于治疗镰状细胞病、β-地中海贫血、退行性疾病转甲状腺素蛋白(TTR)淀粉样变性和先天性眼病,同时也尝试罕见病(如儿童早老症、重症联合免疫缺陷病及家族性高胆固醇血症)和常见病(如癌症和HIV感染)的新疗法[1,2]。

●其他方面
此外,CRISPR技术还推动农业技术进步,包括生产光滑皮毛表型的基因编辑牛和营养价值更高的番茄等[1,2]。
CRISPR/Cas基因编辑技术现在和未来
◆现在
基因组编辑技术的问世为细胞和基因疗法治疗甚至治愈癌症奠定了基础。CRISPR/Cas疗法的应用不胜枚举,其中镰状细胞病(SCD)的疗法称得上是价值和风险共存的极佳案例。目前FDA批准了至少8个基于CRISPR的SCD疗法临床试验,且有更多针对血液系统疾病的试验正在进行中或是即将开始。然而,广泛利用CRISPR/Cas系统治愈SCD仍面临诸多困难。为了将基因组编辑技术作为一种标准疗法,需要解决为每一个患者量身定制基因编辑细胞的难题、骨髓移植相关的安排协调问题,以及昂贵的价格问题。但如果一种新的基因组编辑器递送形式问世,不再需要体外细胞编辑和骨髓移植,CRISPR疗法将发生翻天覆地的变化,进入全新的时代,基因疗法技术会得到更加广泛的应用[1,2]。
CRISPR/Cas基因编辑技术在临床应用之外,正对农业和畜牧业产生深远影响。CRISPR编辑食物正准备进入市场,包括CRISPR/Cas基因编辑技术改良的营养丰富的番茄等。这些农业应用中,CRISPR实现了小片段基因改变的精确"转移",让目标性状能够从一个物种转移至另一个一一其他任何方法都无法实现。除了小片段基因外,CRISPR也具有产生性的基因变异和复杂基因编辑的潜力,这在技术出现前从未在自然界中观察到。一个关键的案例是近期利用多重编辑在小麦中同时敲除和激活不同的基因,引入抗病性的同时恢复生长能力和产量。这些只是各式基因组编辑技术的开始,这项技术在未来将继续对我们的生活产生影响[1,2]。
◆未来
CRISPR/Cas9作为细菌免疫系统的一部分,利用RNA导向机制识别并剪切DNA序列。这一基础的生物化学过程成了基因组编辑技术的基础,拓宽了基础和应用生物学研究的边界,从发育生物学和植物遗传学,到镰状细胞病的医疗方法和畜牧业。新的基于CRISPR的酶以及和CRISPR相关的酶将不新出现,帮助我们更好地理解微生物系统的生物学本质,并利用它们在其他细胞和有机体中进行基因组编辑。CRISPR/Cas9和CRISPR/Cas12a是最为广泛应用的基因组编辑酶,成为全球科研实验室的工具。基因编辑技术赋能的基础研究证实了CRISPR技术的跨领域本质,也展现其作为可用工具出现的良好时机,其广泛应用反过来推动CRISPR工具箱进步,用于特定核甘酸的精准编辑,以及整合产生新的遗传信息。在未来的十年中,基因组编辑研究和应用将会继续加速,并与机器学习、活细胞成像和更快、更便宜的测序技术结合。上一个十年的研究重点在于建立CRISPR平台,那么这些平台在下一个十年将会展现出真实世界中的影响力。在诊所中我们将看到更多各式各样的临床试验,为开发下一代基因和细胞疗法提供数据基础。随着临床应用的扩展,CRISPR或将成为一种保护健康的工具[1,2]。
在农业中:CRISPR筛选将继续帮助洞见基因工程中动植物的多基因性状。利用CRISPR开发的产品——无论是用于移植的猪器官、抗干旱的高产稻米,或是利用CRISPR编辑技术进行精细的微生物组调节以保持健康——都将成为常规[1,2]。
生态保护和环境治理:CRISPR/Cas基因编辑技术还可以用于保护濒危物种、恢复生态平衡,对抗气候变化等环境挑战。基因编辑还可以用于环境修复、资源利用和生态系统管理等方面[1,2]。
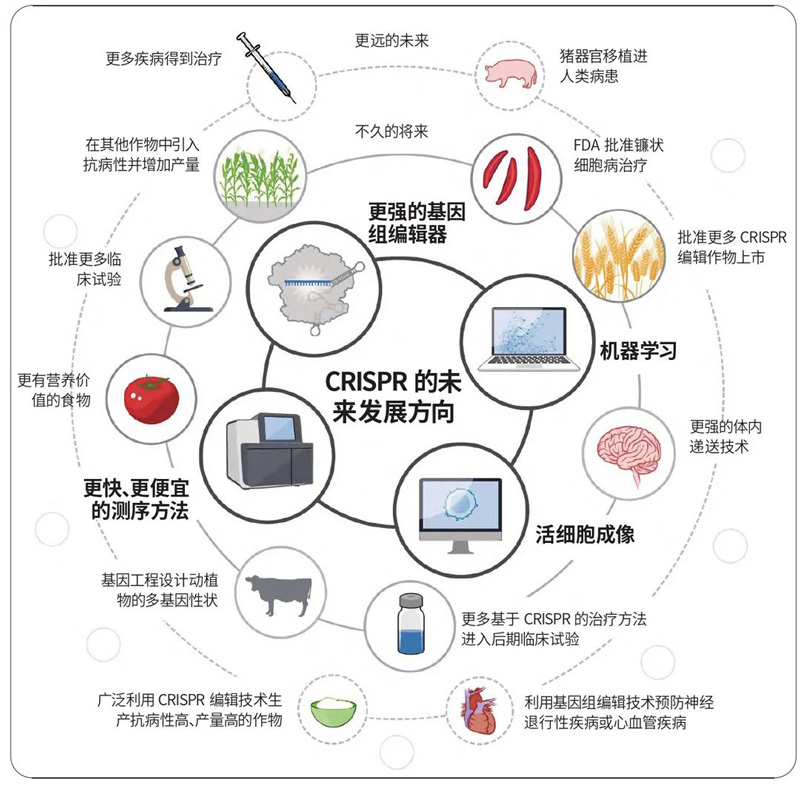
CRISPR/Cas基因编辑技术未来发展方向[1]
结语
CRISPR/Cas基因编辑技术优势非常明显。首先,它具有高度的精确性和特异性,能够针对性地编辑目标基因,避免对其他基因的影响。其次,CRISPR基因敲除相对简便、高效且经济实惠,相较于传统的基因编辑方法,如转座子和核酸酶等,更为便捷。CRISPR基因敲除还可以在不同生物系统中应用,包括细菌、植物、动物以及人类细胞。
此外,CRISPR/Cas基因编辑技术的应用非常广泛。在科学研究领域,它被用于探索基因功能、鉴定疾病相关基因和研究疾病机制,而且CRISPR/Cas基因编辑技术还被广泛应用于药物研发、治疗基因缺陷和传染病等方面。在农业方面,CRISPR/Cas基因编辑技术可以用于改良农作物的性状、提高产量和抗病性。总的来说,CRISPR/Cas基因编辑技术具有广泛的应用前景和重要的研究意义。需要注意的是,在使用该技术时需要谨慎,确保编辑精确性和避免可能的副作用[5-8]。
参考文献:
[1] 传植,乔伊·王,詹妮弗·杜德纳.CRISPR十年:基因编辑技术初露锋芒[J].世界科学,2023,(05):4-13.
[2] Wang JY, Doudna JA. CRISPR technology: A decade of genome editing is only the beginning. Science. 2023 Jan 20;379(6629):eadd8643.
[3] Agarwal N,Gupta R.History,evolution and classification of CRISPR-Cas associated systems. Prog Mol Biol Transl Sci. 2021;179:11-76.
[4]高维崧,窦金萍,韦双等.CRISPR/Cas系统的分类及研究现状[J].生物技术进展,2022,12(04):532-538.
[5] Kim D, Bae S, Park J,et al. Digenome-seq:genome-wide profiling of CRISPR-Cas9 off-target effects in human cells.Nat Methods.2015 Mar;12(3):237-43.
[6]于宗菲,翁丽涵,孙诚诚,曹晓钰,叶振.CRISPR/Cas9系统技术难关:脱靶效应及其优化方法[J].山东第一医科大学(山东省医学科学院)学报,2023,44(01):74-80.
[7] Lei Z,Meng H,Lv Z,et al.Detect-seqrevealsout-of-protospacer editing and target-strand editing by cytosine base editors.Nat Methods.2021 Jun;18(6):643-651.
[8]黄鑫,朱健康,尹军祥,郭伟,桑晓冬,赵添羽,卢姗,袁天蔚,李苏宁.医学领域颠覆性技术发展现状、问题及展望[J].世界科技研究与发展:1-17.








