外泌体:人体内具有多效性功能的细胞间运输系统
外泌体是细胞分泌的纳米级细胞外小囊泡,携带核酸、蛋白质、脂质等生物活性物质,在机体的生理和病理过程中发挥作用。与脂质体和纳米颗粒等合成载体相比,外泌体的内源性和异质性使其在疾病诊断和治疗领域具有广泛而独特的优势。越来越多的证据表明外泌体在预后、诊断甚至治疗方面发挥着不可替代的作用[1]。
外泌体:人体内具有多效性功能的细胞间运输系统[1]
外泌体简介
▶外泌体的发现史
1981年,Trams等人将质膜源性囊泡统称为外泌体,并首次提出了“外泌体”的概念,认为外泌体是具有5′-核苷酸酶活性的膜囊泡,可能具有生理功能,起源于各种细胞系培养物的渗出物。
随后定义的外泌体(40~100nm)最早于1983年7月在绵羊网织红细胞中被发现,Johnstone等人在网织红细胞成熟过程中追踪转铁蛋白受体,发现外泌体的形成是成熟红细胞中转铁蛋白受体丢失的机制。为了与其他类型的细胞外囊泡(EVs)区分,它们被命名为外泌体。值得注意的是,所有细胞,包括原核和真核生物,释放细胞外囊泡作为其正常生理活动和获得性异常的一部分。
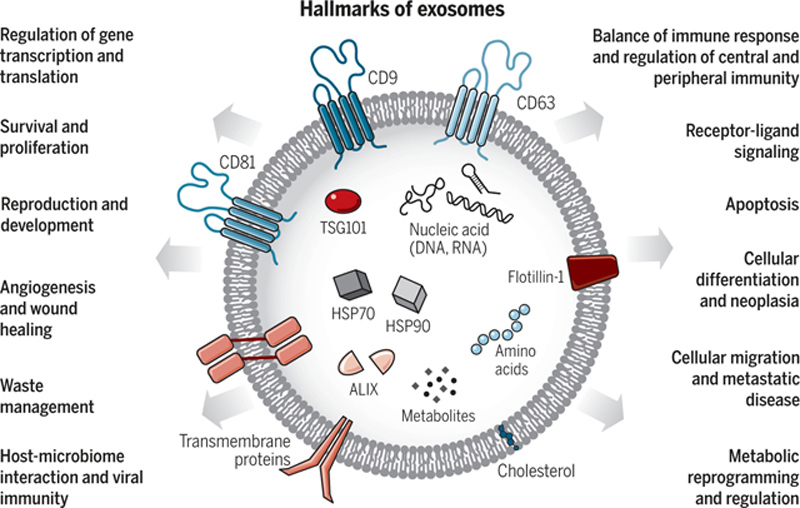
当前认为细胞外囊泡大致可分为ectosomes(胞外体/核外颗粒体)和exosomes(外泌体)两大类:ectosomes是通过质膜向外出芽产生的囊泡,其包含了微囊泡、微颗粒,以及直径约在50nm~1μm之间的大囊泡等;外泌体是直径约40~160nm(平均约100nm)的、来源于内体(endosomes)、由细胞分泌的球形脂质双层囊泡,在蔗糖密度梯度溶液中以1.13~1.19g∙mL−1的密度漂浮[1]。
▶外泌体的蛋白成分
研究发现外泌体含有核酸、蛋白质、脂质、细胞因子、转录因子受体等生物活性物质。其中外泌体蛋白成分主要分为两类:一类是公共成分,参与囊泡形成和分泌过程,包括膜运输和融合相关蛋白(如Rab、GTPases)、热休克蛋白(如HSP70、HSP90)、四跨膜蛋白超家族(如CD63、CD81)、ESCRT复合物相关蛋白(如Tsg101、Alix)、整合素等;另一类是特异性成分,与它们的祖细胞密切相关,即细胞特异性成分,如来源于抗原提呈细胞的CD45和MHC-II。
▶外泌体的异质性
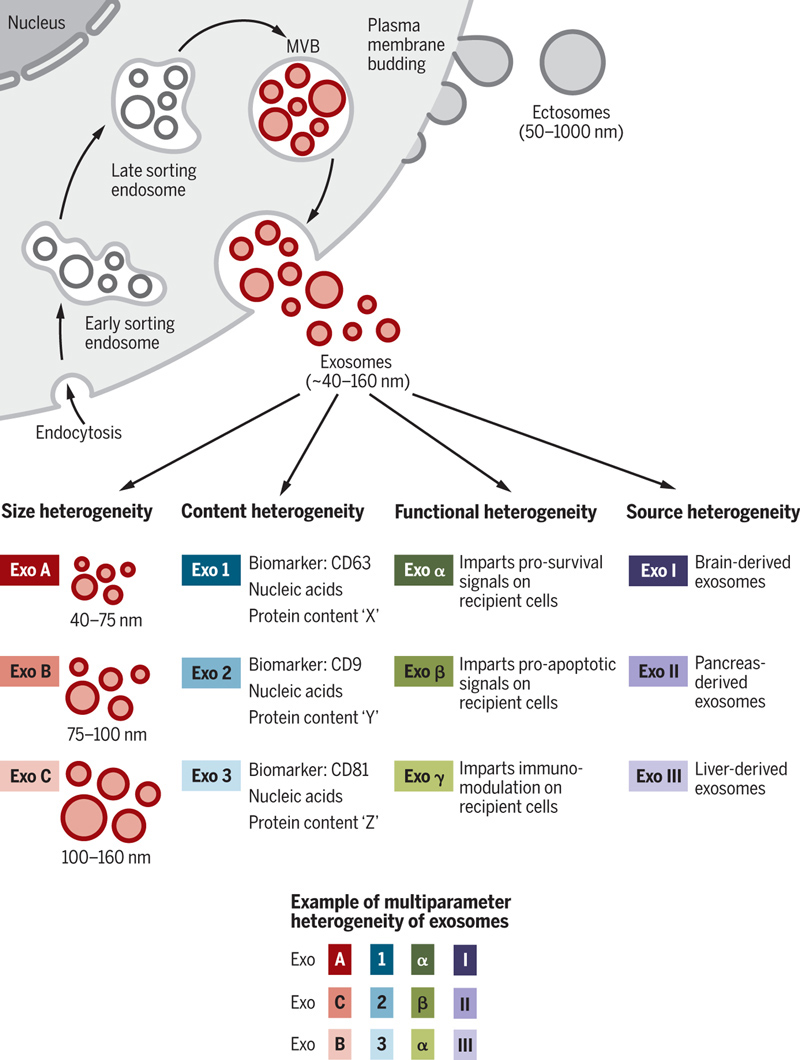
外泌体的异质性主要包括大小、成分(含量)、对受体细胞的功能影响和来源细胞,这些异质性对外泌体应用具有重大的影响[1]。
●外泌体大小异质性:大小不等可能是由于细胞内多膜体(MVB)的限制膜不均匀内陷,导致液体和固体的总含量不同,或包括其他EVs的分离方法。应用EVs的精细分离方法显示,外泌体可能包含由不同大小范围定义的亚群体。大小的异质性也会导致外泌体含量的不同。
●外泌体成分异质性:细胞的微环境和固有生物学可能影响外泌体及其生物学标记物的含量。
●外泌体功能异质性:由于细胞表面受体的表达不同,外泌体对受体细胞的作用也不同,这种功能异质性可以导致不同靶细胞类型中的一组外泌体诱导细胞存活,另一组诱导细胞凋亡,另一组诱导免疫调节等。
●外泌体来源异质性:外泌体异质性也可以基于外泌体起源的器官和组织,包括它们是否来自癌细胞,这赋予它们独特的特性,如对某些器官的趋向性和被特定细胞类型的吸收。所有这些特征的结合将有可能产生更高层次的复杂性和异质性的外泌体。
外泌体的异质性[1]
外泌体生物发生
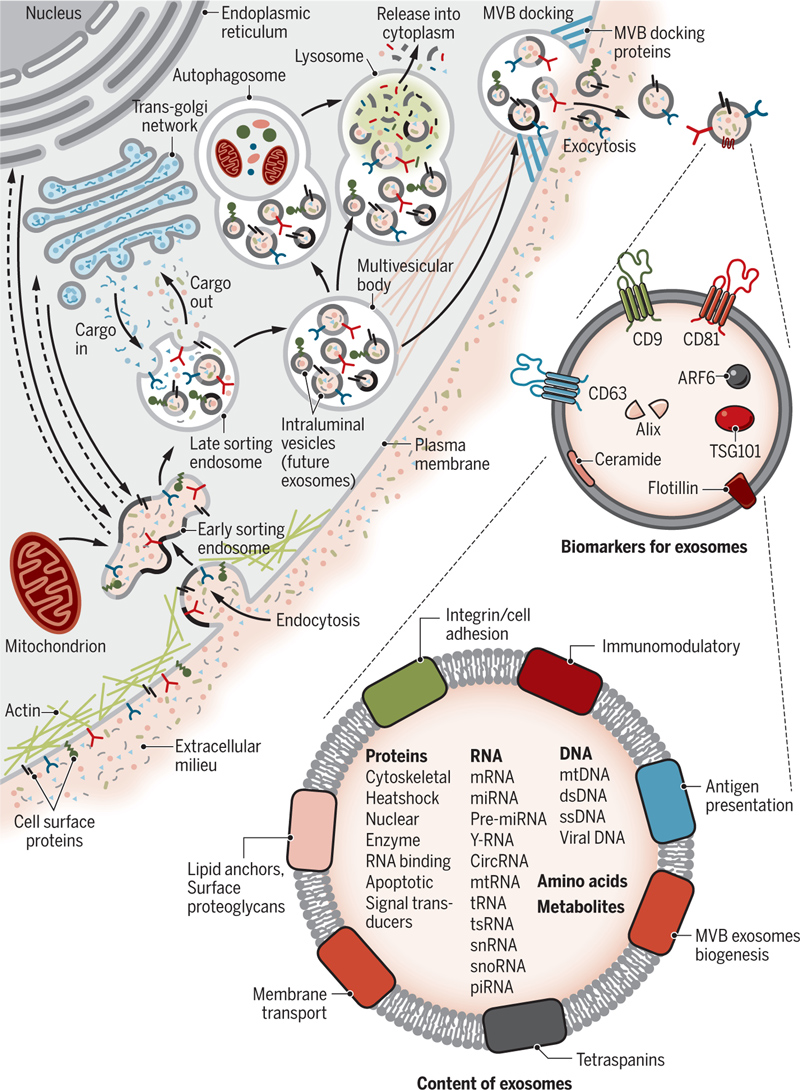
外泌体的生物发生始于早期内体,可以由许多因素诱导,例如微生物和细胞外刺激或其他应激条件。在某种因素的作用下,细胞膜发生内吞作用向内凹陷,这个过程形成的内膜称为早期核内体。早期的核内体将继续在细胞内迁移,从细胞外围移向细胞核,并在此过程中逐渐成熟,表现为从原来的管状逐渐变成到球形。当早期核内体成熟为晚期核内体时,内膜会进一步形成多个凹陷,包封一部分细胞质和一些物质(如核酸、高尔基体蛋白和细胞核),从而产生腔内囊泡(ILVs),形成多胞体(MVBs)。这些MVBs也可以与其他细胞内囊泡和细胞器相交,从而促进外泌体成分的多样性。接下来,含有ILVs的MVBs与溶酶体或者细胞膜融合。如果MVBs与溶酶体融合,它们将被完全降解;若MVBs与细胞膜融合,其内容物(ILVs)可以释放到细胞外环境中,释放的囊泡便是外泌体[1]。
外泌体的生成[1]
外泌体可以与细胞外基质相互作用,影响周围细胞,并通过体液将其内容物运送到靶细胞,ESCRT(运输所需的内体分选复合体)、Alix等相关蛋白或辅助因子在外泌体的形成中发挥着不可替代的作用。此外,一些脂质和蛋白质也调节这一过程。
外泌体的临床价值
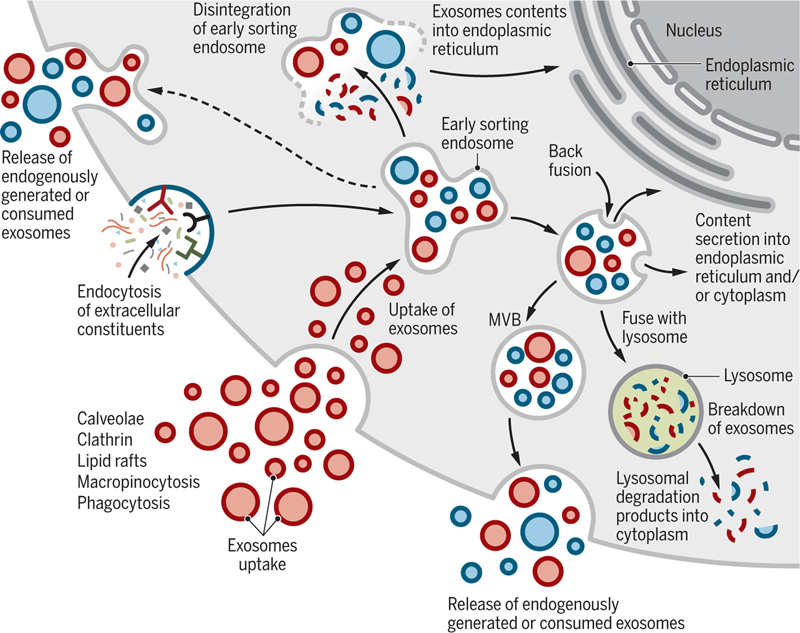
由于起源于细胞,外泌体包含细胞的许多成分,包括DNA、RNA、脂质、代谢物、细胞质和细胞表面蛋白质等。外泌体可以将这些成分传递到受体细胞中,有效地改变受体细胞的生物学反应,这种外泌体介导的反应可促进或抑制疾病的进程。因此,外泌体具有调节复杂细胞内通路的内在特性,这提高了它们在许多疾病治疗控制中的潜在应用,包括神经退行性疾病和癌症等疾病。
外泌体还可以被设计成递送多种药物的有效载体,包括负载短的干扰RNAs、反义寡核苷酸、化疗药物和免疫调节剂等,同时具有将其递送到所需目标的能力。作为载体,外泌体的脂质和蛋白质组成还可能影响这些药物的药代动力学特性,外泌体的这些天然成分在提高生物利用度和减少不良反应方面也可能发挥作用。此外,外泌体还具有辅助疾病诊断的潜力。它们在所有生物体液中都有报道,并且通过生物体液取样(液体活检)获得外泌体,可以利用外泌体的多组分分析来确定疾病进展和对治疗的反应。
治疗性外泌体的细胞摄取[1]
近年来,外泌体在临床试验中得到了广泛的研究,临床试验中使用的外泌体主要有两种,分别是人类细胞/样品外泌体和植物标本外泌体,主要应用是生物标志物、外泌体治疗、药物传递系统和癌症疫苗。据临床实验网站统计显示,不同条件下的人源样本外泌体临床试验共记录了116项,其中58项(50%)属于生物标志物应用;在外泌体治疗方面,记录了33项(28.44%)相关研究;对于药物递送系统的相关试验,记录了6项(5.17%);而对于外泌体基础分析,记录了17项(14.66%)研究;2项临床试验(1.72%)与外泌体疫苗研究有关。
外泌体的研究是一个活跃的研究领域,正在进行的技术和实验进展可能会产生有关其异质性和生物学功能的宝贵信息,并增强我们利用其治疗和诊断潜力的能力。
参考文献:
[1] Kalluri R, LeBleu VS. The biology, function, and biomedical applications of exosomes. Science. 2020 Feb 7;367(6478):eaau6977.








